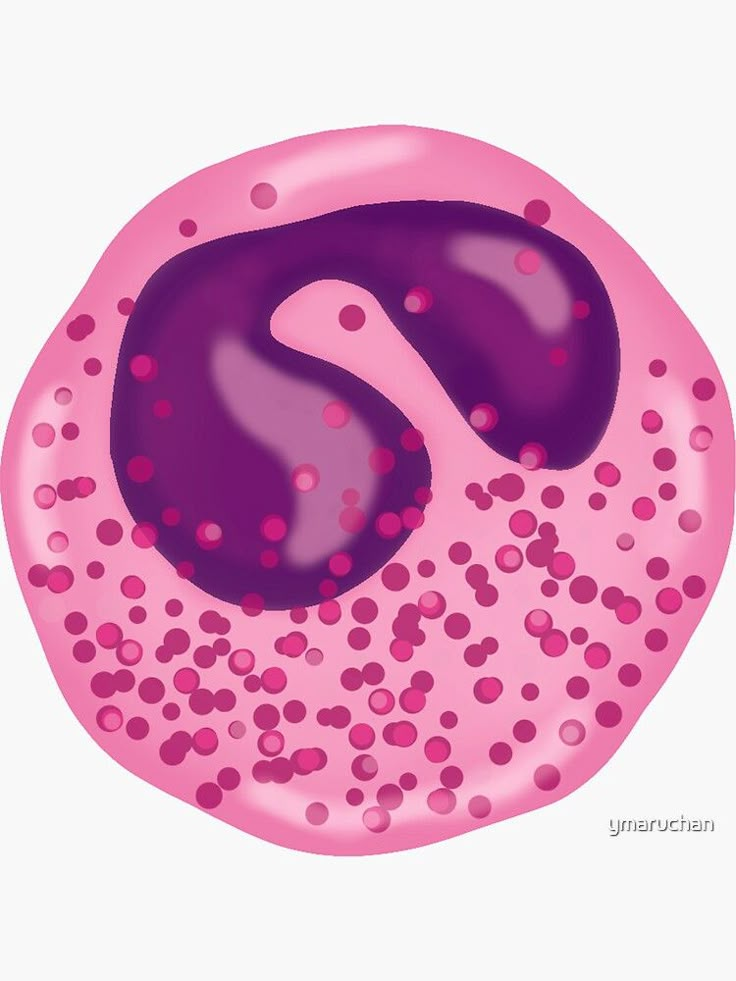
La tinción de Hematoxilina-Eosina (H&E) es la técnica histológica más utilizada en el mundo. Es el estándar con el que se identifican tejidos, estructuras celulares, patrones patológicos y alteraciones morfológicas en muestras clínicas. Dominarla no solo es fundamental para trabajar en anatomía patológica, sino también para comprender cómo se comportan los colorantes, cómo se fijan y cómo se realzan los detalles microscópicos.
En este artículo hablaremos paso a paso sobre cómo se realiza una tinción de H&E, qué función tiene cada reactivo, los tiempos más utilizados, qué aspecto debe tener la muestra y cuáles son los errores más comunes que pueden arruinar una preparación. Todo explicado para estudiantes y personas que buscan perfeccionar su técnica en laboratorio.
🧪 ¿Qué Es La Tinción H&E?
La tinción Hematoxilina-Eosina es una técnica histológica que utiliza dos colorantes complementarios:
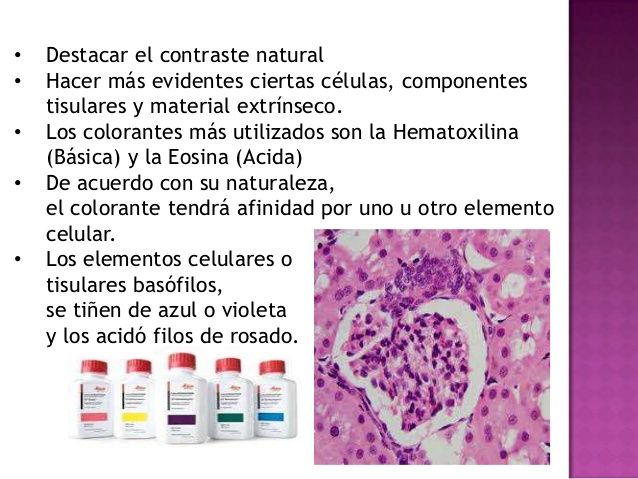
- Hematoxilina: tiñe los componentes ácidos como el núcleo (color azul/morado).
- Eosina: tiñe los componentes básicos o citoplasmáticos (color rosa/rojo).
Permite diferenciar con claridad núcleos, citoplasmas, fibras, eritrocitos y matriz extracelular.
🔧 Materiales Y Reactivos
- Hematoxilina (Mayer, Harris o Gill)
- Diferenciador (alcohol ácido)
- Agua corriente o agua amoniacal (bluing)
- Eosina Y o Eosina-Floxina
- Alcohol 70%, 95% y 100%
- Xileno
- Medio de montaje (DPX, bálsamo, etc.)
- Cubetas de tinción
- Porta y cubreobjetos
🧼 Preparación Inicial: Desparafinado Y Rehidratación
Antes de teñir, el tejido debe quedar libre de parafina y rehidratado.
👉 1. Xileno (2–3 baños, 3–5 min cada uno)
Elimina completamente la parafina.
👉 2. Alcoholes en gradiente
- Alcohol 100%
- Alcohol 95%
- Alcohol 70%
Reduce la concentración hasta llegar al agua.
👉 3. Agua destilada
La muestra debe quedar totalmente hidratada antes de teñir.
🔵 Paso 1: Tinción Con Hematoxilina
La hematoxilina tiñe los núcleos.
✔️ Proceso estándar
- Sumergir el porta en hematoxilina (5–10 min, depende del tipo).
- Lavar en agua corriente (1–3 min).
- Diferenciar con alcohol ácido: 1–10 segundos.
- Lavar en agua corriente.
- Bluing con agua amoniacal o agua corriente prolongada para fijar el color azul.
Resultado esperado: núcleos azul intenso, nítidos y sin halos.
🌸 Paso 2: Tinción Con Eosina
La eosina tiñe citoplasmas, fibras y eritrocitos.
✔️ Proceso estándar
- Sumergir en eosina (30 segundos a 2 minutos).
- Ajustar tiempo según la intensidad deseada:
- Menos tiempo = rosa más claro
- Más tiempo = citoplasmas más rojos
Resultado esperado: citoplasmas rosa uniforme y eritrocitos rojo intenso.
🔄 Paso 3: Deshidratación
Después de teñir, la muestra debe volver a alcoholes para fijar la eosina.
Secuencia clásica:
- Alcohol 70% (breve)
- Alcohol 95%
- Alcohol 100% (dos cambios)
🌫️ Paso 4: Aclaramiento Con Xileno
El xileno hace la muestra transparente y lista para el montaje.
- 2–3 baños, 2–5 min cada uno.
🧢 Paso 5: Montaje Final
Colocar medio de montaje y un cubreobjetos.
Resultado final:
- Núcleos azul/violeta bien definidos
- Citoplasmas rosa
- Eritrocitos rojo intenso
- Matriz extracelular rosada
- Preparación transparente y limpia
❌ Errores Comunes En La Tinción H&E (Y Cómo Evitarlos)
1️⃣ Núcleos demasiado pálidos
Causa: hematoxilina insuficiente o exceso de diferenciación.
✔️ Solución: aumentar tiempo de hematoxilina.
2️⃣ Citoplasmas demasiado rojos
Causa: tiempo excesivo en eosina.
✔️ Solución: reducir inmersión.
3️⃣ Preparación azulada en exceso
Causa: bluing prolongado.
✔️ Solución: reducir exposición a agua amoniacal.
4️⃣ Cristales o manchas
Causa: xileno contaminado o medio de montaje viejo.
✔️ Solución: renovar reactivos.
5️⃣ Preparación turbia
Causa: deshidratación incompleta.
✔️ Solución: repetir alcoholes al 100%.
6️⃣ Burbujas bajo el cubre
Causa: montaje apresurado.
✔️ Solución: usar técnica del ángulo y revisar antes de sellar.
🎓 Consejos Profesionales Para Estudiantes
- Controla el tiempo exacto de cada paso: la H&E es muy sensible.
- Si un tejido se tiñe débil, repite desde hematoxilina (no hace falta empezar desde cero).
- Evita contaminar cubetas: cambia reactivos con frecuencia.
- Nunca dejes la muestra en alcohol ácido más de unos pocos segundos.
- Observa siempre en 10x primero para comprobar que el teñido es uniforme.